Библиотека
СОДЕРЖАНИЕЭлегаз и его свойства
Синтез гексафторида серы впервые был произведен в лабораториях Facultе' de Pharmacie в Париже в 1900 г. учеными Муасаном и Лебо. Фтор, полученный электролизом, вступал во взаимодействие с серой, и в результате сильной экзотермической реакции получался достаточно устойчивый газ. Со временем были определены физические и химические свойства газа, опубликованные Придо (1906 г.), Шлумбом и Гемблом (1930 г.), Клеммом и Хенкелем (1932-35 г.г.) и Естом и Клауссоном (1933 г.).

В их работах особенное внимание уделялось химическим и диэлектрическим свойствам газа. Первое исследование для целей промышленного применения было проведено компанией General Electric в 1937 г. Результаты этого исследования показали, что газ можно использовать в качестве изоляционной среды в электроэнергетике. В 1939 Томсон-Хьюстон запатентовал принцип применения газа SF6 для изоляции кабелей и конденсаторов. После Второй мировой войны различные публикации и способы применения газа стали быстро появляться один за другим:
- 1947 г.: работа по использованию элегаза для изоляции трансформаторов;
- 1948 г.: развитие промышленного производства SF6 в США в корпорацией Allied Chemical и компанией Pennsalt;
- 1960 г.: организация серийного производства SF6 для строительства электростанций в США и Европе, совпадающая с появлением первых элегазовых выключателей и коммутационных аппаратов высокого и сверхвысокого напряжения.
В компании Merlin Gerin исследовательская работа по использованию газа SF6 для изоляции и отключения цепей была начата примерно в 1955 г. Это совпадает с появлением первых промышленных изделий в США.
Впервые промышленное применение газа было осуществлено компанией Merlin Gerin для сверхвысокого напряжения, затем для устройств среднего напряжения:
- 1964 г.: первая подстанция с элегазовой изоляцией заказана EDF и введена в эксплуатацию в районе Парижа в 1966 г.;
- 1967 г.: FA-выключатель был введен в эксплуатацию и постепенно заменил оборудование на сжатом воздухе, которое прочно занимало свое положение во Франции и других странах в течение предыдущих 25 лет;
- 1971 г.: изменения в потребностях промышленности заставили компанию Merlin Gerin начать производство элегазового выключателя среднего напряжения Fluarc.
- В последнее время газ SF6 был принят для использования в коммутационной аппаратуре среднего напряжения, ячейках SM6, контакторах и автоматических выключателей, охватывая все потребности распределения электроэнергии.
Производство SF6
Единственный используемый в настоящее время промышленный процесс производства использует синтез гексафторида серы, при котором фтор, полученный при электролизе, взаимодействует с серой согласно экзотермической реакции, выраженной формулой:
В течение этой реакции формируется некоторое количество других фторидов серы, например, SF4, SF2, S2F2, S2F10, а так же примесей из-за присутствия влажности, воздуха и угольных анодов, используемых для электролиза фтора. Эти побочные продукты удаляются различными способами очистки (рис. 1).
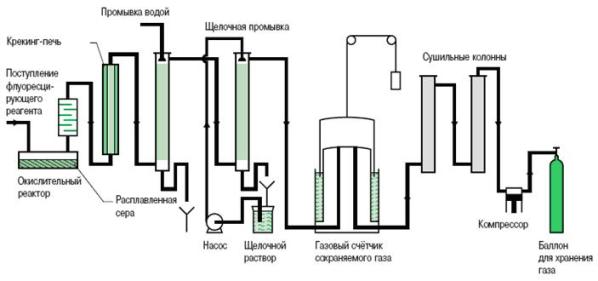
Рис. 1. Процесс производства SF6 путем непосредственного соединения.
Цепь очистки необходима для получения газа высокой степени чистоты. Качество газа SF6 для поставки определяется Руководством МЭК 376, в котором определены допустимые концентрации примесей.
Другие виды применения SF6
Уникальные свойства SF6 привели к его использованию в различных отраслях науки и промышленности, например:
- медицинская сфера: электрическая изоляция в медицинском оборудовании (в рентгеновских установках) или в хирургии;
- электрическая изоляция в научном оборудовании (электронные микроскопы, ускорители частиц, например, генератор Ван дер Графа);
- акустическая изоляция в оконных стеклопакетах;
- газ для отслеживания потока воздуха в вентиляционных системах (например, в шахтах) или в верхних слоях атмосферы;
- газ для обнаружения утечки в герметичных системах;
- создание специальной атмосферы при металлургической обработке алюминия и магния или для военных целей.
Физические свойства
SF6 - один из самых тяжелых известных газов. Его плотность при 20°C и 0,1 МПа (т.е. при давлении, равном одной атмосфере) равна 6,139 кг/м3, почти в пять раз выше, чем у воздуха. Его молекулярная масса составляет 146,06. Он является бесцветным и не имеет запаха. SF6 может находиться в жидком состоянии только при повышенном давлении.
| Плотность, кг/м3 | 6,14 |
|---|---|
| Теплопроводность, Вт/мК | 0,0136 |
| Критическая точка: | |
| - температура, °C | 45,55 |
| - плотность, кг/м3 | 730 |
| - давление, МПа | 3,78 |
| Скорость распространения звука, м/с | 136 |
| Показатель преломления | 1,000783 |
| Теплота образования, кДж/моль | -1221,66 |
| Удельная теплоемкость, Дж/мольК | 96,6 |
Уравнение состояния
Газ гексафторида серы, имеющий уравнение состояния по типу Битти-Бриджмена, до температуры, приблизительно равной 1200°K, ведет себя как идеальный газ:
где: p - давление (Па)
v - объем (м3/моль)
R - константа идеального газа (8,3143 Дж/моль×К)
T - температура Кельвина (K)
a - 15,78×10-6 (1 = 0,1062×10-3 v-1)
b - 0,366×10-3 (1 = 0,1236×10-3 v-1)
Зависимость давления от температуры
Зависимость давления от температуры линейная и относительно небольшая, в диапазоне рабочих температур от -25 до +50°C (рис. 3).

Рис. 3. Кривая давления пара и линии эквивалентной плотности газа SF6.
Удельная теплоёмкость
Объемная удельная теплоёмкость SF6 в 3,7 раз больше, чем у воздуха. Это имеет важные последствия для уменьшения эффектов нагрева в электрическом оборудовании.
Теплопроводность
Теплопроводность SF6 ниже, чем у воздуха, но его полная теплоотдача, в особенности, если учитывается конвекция, очень хорошая, как водорода и гелия, и выше, чем у воздуха. При высоких температурах кривая теплопроводности SF6 (рис. 4) демонстрирует одно из исключительных качеств этого газа, которое позволяет использовать его для гашения дуги путем теплопередачи. Пик теплопроводности соответствует температуре распада молекулы SF6 при 2100 = 2500°K. В процессе распада поглощается значительное количество теплоты, испускаемой при преобразовании молекул на периферии дуги, ускоряя теплообмен между горячими и более прохладными областями.
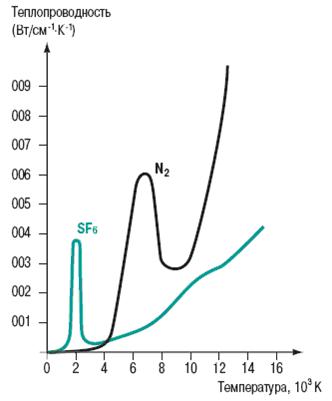
Рис. 4. Теплопроводность SF6 и азота.
Электрические свойства
Превосходные диэлектрические свойства SF6 происходят вследствие электроотрицательного типа его молекулы. Газ имеет явную тенденцию к захвату свободных электронов, образуя малоподвижные тяжелые ионы, вследствие чего развитие электронных лавин становится очень трудным.
Диэлектрическая прочность SF6 приблизительно в 2,5 раз выше, чем у воздуха при тех же условиях. Преимущество SF6 как диэлектрика по сравнению с азотом хорошо заметно на кривой (рис. 5).

Рис. 5. Напряжение пробоя как функция произведения pd
между двумя сферами диаметром 5 см,
p - давление (МПа), d - расстояние между электродами (10-3м).
Для неоднородных полей (рис. 6) максимальное напряжение пробоя получается при давлении приблизительно равном 0,2 МПа.

Рис. 6. Напряжение пробоя как функция давления для неоднородного электрического поля.
Вследствие низкой температуры распада и высокой энергии распада SF6 является идеальным газом для гашения дуги. Когда электрическая дуга охлаждается в SF6, она остается проводящей до относительно низкой температуры, таким образом, минимизируя прерывание тока перед переходом через ноль, и тем самым, избегая высоких перенапряжений.
В таблице приведены основные электрические характеристики SF6.
| Поле пробоя в зависимости от давления | 89Вм-1Па-1 |
|---|---|
| Относительная диэлектрическая постоянная при 25°C и 1 баре абс. давл. | 1,00204 |
| Коэффициент потерь при 25°C и 1 баре абс. давл. | <2×10-7 |
| Коэффициент ионизации | α=ApE/(p-B) A=2,9×10-2В2 B=89Вм-1Па-1 |
Химические свойства
Гексафторид серы полностью удовлетворяет требованиям к валентности молекулы серы. Его молекулярная структура представлена восьмигранником с молекулами фтора на каждой вершине. Эффективный диаметр столкновения молекулы SF6 – 4,77 Е. Шесть связей являются ковалентными, что объясняет исключительную стабильность этого соединения.
- SF6 можно нагреть без его распада до 500°C в отсутствии каталитических металлов.
- SF6 не воспламеняется.
- Водород, хлор и кислород не оказывают никакого воздействия на этот газ.
- SF6 не растворяется в воде.
- Кислоты не оказывают никакого воздействия на этот газ.
В чистом состоянии SF6 нетоксичен, что регулярно подтверждается на новом газе перед его поставкой. Для проверки мышей помещают на 24 часа в атмосферу, состоящую на 80% из SF6 и на 20% - из кислорода (биологическое исследование, рекомендованное Международной электротехнической комиссией МЭК 376).
Продукты разложения дуги
В электрической дуге температура может достигать 15000°K, и малая часть SF6 при этом распадается. Продукты распада формируются при следующих условиях:
- электрическая дуга, сформированная при расхождении контактов, обычно состоящих из сплавов на основе вольфрама, меди и никеля, содержащих остаточные количества кислорода и водорода;
- такие примеси в SF6, как воздух, CF4 и водяной пар;
- изолирующие компоненты, включающие пластмассы на основе углерода, водорода и диоксида кремния;
- другие металлические или неметаллические материалы, из которых произведено оборудование.
Вышесказанное объясняет, почему твердые и газообразные продукты распада содержат (помимо фтора и серы) такие элементы как углерод, кремний, кислород, водород, вольфрам, медь и т.д. Принципиальные газообразные побочные продукты, идентифицированные в лабораториях, исследующих данный вопрос, объединяющие хроматографию газовой фазы с масс-спектрометрией, следующие:
- фтористоводородная кислота - HF;
- диоксид углерода - CO2;
- диоксид серы - SO2;
- тетрафторид углерода - CF4;
- тетрафторид кремния - SiF4;
- фторид тионила - SOF2;
- фторид двуокиси серы - SO2F2;
- дисерный декафторид - SF4;
- тетрафторид серы - S2F10.
Некоторые из этих побочных продуктов могут быть токсичными, но большинство из них очень легко адсорбируется такими материалами как активированный оксид алюминия или молекулярные сетки. Некоторые побочные продукты также образуются в чрезвычайно малых количествах (S2F10).
Если адсорбент (молекулярная сетка или активированный оксид алюминия) присутствует в оборудовании в достаточном количестве, то уровень коррозии из-за продуктов распада SF6 (фтористоводородной кислоты, в частности) является очень невысоким, а то и вообще незначительным. Причина этого в том, что адсорбенты действуют настолько быстро и эффективно, что коррозийные газы не успевают реагировать с другими присутствующими материалами.
Однако, чтобы избежать любого риска, компания Merlin Gerin запретила использование некоторых материалов и составляющих с признаками распада, после длительных испытаний с высоким уровнем загрязнения при отсутствии адсорбентов.
Санитарно-гигиенические характеристики чистого SF6
Чистый SF6 нетоксичен и биологически нейтрален. Испытания, проведенные на животных, показали, что при наличии газа SF6 в концентрации до 80% и 20% кислорода неблагоприятные эффекты отсутствуют.
Несмотря на то, что вдыхаемый воздух может содержать высокую концентрацию SF6, на здоровье какие-либо вредные эффекты не влияют. Максимальная концентрация газа в производственных помещениях, где рабочие находятся до восьми часов в день пять раз в неделю, не должна превышать 1000 ppmv (6000 мг/м3). Данное предельное пороговое значение (TLV) обычно используется для безопасных газов, обычно не присутствующих в атмосфере.
Чистый SF6 не оказывает какого-либо вредного воздействия на окружающую среду, мутагенного или канцерогенного влияния на здоровье (ни на ДНК, ни на эпигенез). Поэтому при работе с новым SF6 достаточно принять процедуры, гарантирующие, что указанная максимальная концентрация не превышена.
Вследствие производственного процесса, серийно выпускаемый SF6 не совершенно чист. Разрешенные уровни примесей установлены в стандарте Международной электротехнической комиссии МЭК 376 показаны в таблице.
| Примесь | Макс. допуст. кол-во |
|---|---|
| CF4 | 500ppm (вес.) |
| O2, N2 | 500ppm (вес.) |
| Вода | 15ppm (вес) |
| HF | 0,3ppm (вес) |
| Гидролизный фторид | 1,0ppm (вес), выражено в HF |
Оценка риска здоровью, оказываемого SF6 при горении дуги
Уровень риска здоровью, оказываемого используемым SF6, зависит от ряда факторов:
- степени распада SF6 и типов присутствующих продуктов распада;
- растворения используемого SF6 в окружающей среде;
- времени, в течение которого человек находится в среде, содержащей использованный SF6.
Определение TLV – предельного порогового значения
Потенциально токсичным газам присваивается величина, известная как TLV, которая выражает их концентрацию в воздухе, обычно в частях на миллион по объему (ppmv). TLV - средневзвешенная по времени концентрация, безвредная для здоровья при нахождении в ней в течение 8 часов в день и 40 часов в неделю.
Оценка токсичности с использованием концентрации SOF2
Несмотря на то, что используемый SF6 содержит многокомпонентную смесь химических веществ, как было показано, один конкретный элемент доминирует при определении токсичности. Это газообразный продукт распада фторид тионила SOF2. Доминирование этого компонента следует из его высокой нормы выработки (образованный объем в л на энергию дуги в кДж) по сравнению с нормами выработки других продуктов распада в сочетании с его уровнем токсичности. TLV для SOF2 составляет 1,6 ppmv. SOF2 может далее реагировать с водой, приводя к образованию диоксида серы SO2 и фтористоводородной кислоты HF. Однако, вследствие схожей концентрации и значений TLV полное оказываемое токсичное воздействие подобно воздействию SOF2 или продуктов его гидролиза.
В нижеприведенной таблице сравниваются три продукта распада:
- фторид тионила SOF2;
- серный фторид SO2F2;
- дисерный декафторид S2F10.
Первые два продукта являются самыми широко распространёнными продуктами распада в результате дуги в SF6, тогда как последний продукт считается наиболее ядовитым.
Чтобы оказывать токсичное воздействие, химический реагент должен присутствовать в достаточном количестве относительно его TLV. «Индекс риска» в таблице указывает относительные вклады трех продуктов распада в полную токсичность газа. В типичном образце дугового SF6 вклад продукта SOF2 в токсичность превышает вклад продукта SO2F2 примерно в 200 раз, а вклад продукта S2F10 - примерно в 10000 раз. Вкладом в токсичность продукта S2F10 можно явно пренебречь, то же относится и к SO2F2.
| Фторид тионила SOF2 | Серный фторид SO2F2 | Дисерный декафторид S2F10 | |
|---|---|---|---|
| Норма выработки (л/кДж) | 3,7×10-3 | 0,06×10-3 | 2,4×10-9 |
| TLV (ppmv) | 1,6 | 5 | 0,01 |
| Норма выработки относительно SOF2: Pr | 1 | 0,016 | 0,65×10-6 |
| Токсичность относительно SOF2: Tr | 1 | 0,32 | 160 |
| Индекс риска: Pr×Tr | 1 | 5,12×10-3 | 0,104×10-3 |
